废水中氨氮处理技术分析(一)
2022-04-28 来自: 环保水圈 浏览次数:760
氨氮废水成分复杂,可生化性较差,去除方法主要以折点氯化法和吹脱法等常规物化脱氮技术和生物脱氮为主,其中物化脱氮存在二次污染、处理成本较高等问题,而低碳氮比条件下,生物脱氮难以较好地实现对氮的去除。电化学氧化法因具有运行成本低、效率高、无二次污染、设备简单等特点,兼具氧化、气浮、絮凝、杀菌等作用已越来越多地用于含氨氮废水的处理。

废水中氨氮的电化学氧化过程包括直接氧化和间接氧化。直接氧化是指氨氮在失去电子,转化成N2去除;而间接氧化主要通过电解过程中产生的羟基自由基、过氧化氢、活性氯(Cl2、HOCl和OCl-)和过硫酸根等强氧化剂氧化氨氮并将其去除。褚衍洋等采用Ti/TiO2-RuO2-IrO2考察了氨氮的直接电化学氧化及其在两种液相电解质体系下(存在氯离子与否)的氧化效果,发现不存在氯离子时NH4+-N的电化学氧化可被忽略,但游离态氨氮(NH3-N)在约1.25 V 电位下可发生直接氧化;当电解质中存在氯离子时,有效氯的生成使氨氮的氧化效率显著提高,在碱性体系下氨氮的去除包括间接电化学氧化和直接电化学氧化,但以前者为主。朱艳等采用自制PbO2粉末多孔电处理氨氮废水,发现投加氯离子能显著提高氨氮的电化学氧化速率;氯离子存在条件下,氨氮的去除主要靠电催化过程产生的强氧化性·OH、HClO的作用,其去除率随初始pH 的加大而加大。
在常用的材料中,掺硼金刚石(BDD)薄膜是一种具有众多优良特征的新型材料,其强度高、耐磨损、导热性良好、耐腐蚀性强,并具有电化学反应中的高析氧电位、低背景电流、良好的化学稳定性等,引起人们的广泛关注。BDD可用于处理氨氮废水,主要是因为BDD电势窗口很宽,高达3.5 V以上,具有很高的析氧电位,除能在表面直接氧化降解氨氮外,还可通过表面催化产生的大量强氧化性自由基间接氧化分解氨氮。笔者主要探讨了BDD处理废水氨氮时的直接氧化和间接氧化机理。
一、材料和方法
1、试验药品
模拟氨氮废水由(NH4)2SO4和去离子水配制而成。初始NH4+-N质量浓度为100 mg/L,电导率用Na2SO4调节到5.5~6 mS/cm,pH用H2SO4溶液和NaOH溶液调节,Cl-由NaCl配制,COD由邻苯二甲酸氢钾配制。所有化学药品均为分析纯。所有溶液都由去离子水配制而成。
2、电解装置
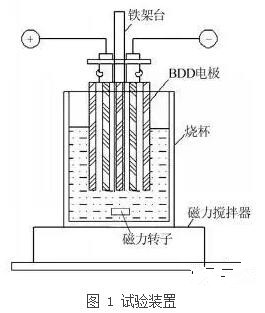
BDD的板间隔为2 mm,阴阳板共 5块,板尺寸为195 mm×26 mm×2 mm,电源为 DH1716-7A直流稳压稳流电源,电化学反应在磁力搅拌下的烧杯中进行(见图 1),处理废水体积为3 L。电化学反应采用恒流模式,根据所需电流密度设定电流值,控制每次反应总取样量不超过废水体积的百分之五。
3、分析方法
NH4+-N采用纳氏试剂法测定,余氯采用碘量法测定。按正确顺序放入25 mL电解槽内,并与CHI660D型电化学工作站连接,对整个体系进行循环伏安扫描。
二、结果与讨论
1、氨氮的直接氧化机理
在1 mol/L Na2SO4溶液中考察不同pH下100 mmol/L (NH4)2SO4在BDD上的循环伏安曲线,扫描速率100 mV/s,如图 2所示。在pH为5的酸性条件和pH为7的中性条件下,溶液中的氨氮主要以NH4+形式存在,曲线1和曲线2在-3~3 V电位内没有出现氨氮的氧化峰,说明氨氮在BDD上并没有发生直接氧化;当阳电位超过2.4 V后电流迅速增加,说明BDD周围发生了析氧反应,H2O被氧化为O2。在pH为10的碱性条件下,电位为1.88 V时氨氮氧化峰出现,这说明在碱性条件下氨氮在BDD上发生直接氧化。pH>8时溶液中的氨氮以NH3形式存在,并在BDD上被直接氧化,转化为N2。其氧化过程如式(1)~式(5)所示。这一结论与E. Moran等和褚衍洋等的研究结果一致。
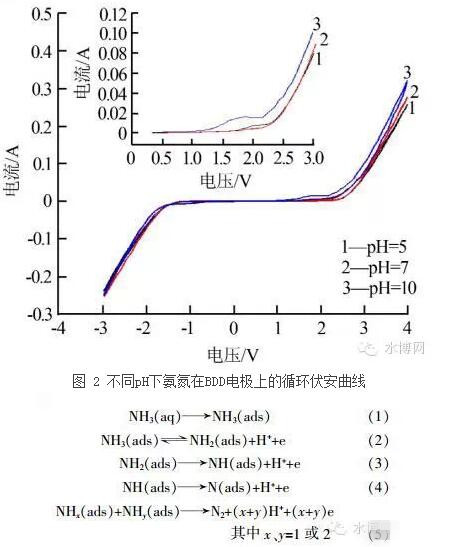
由此可知,氨氮发生直接氧化应该满足两个条件:
(1)要在碱性条件下进行。碱性条件下,以游离态NH3存在的氨氮可以发生直接氧化。
(2)要选择适合的材料。不同电材料的氨氮氧化电位和析氧电位不同,若二者差值不大,析氧反应不利于氨氮氧化反应发生。BDD电在1.8 V左右易发生游离态NH3的氧化反应,而其析氧电位在2.6 V左右,二者差值较大,这也是BDD电氧化氨氮电流效率较高的原因之一。
鉴于大多数氨氮废水的pH均在中性偏碱性范围,探讨了无氯离子存在下氨氮的去除率。根据前期实验,选取电流密度分别为3.9×10-3、7.9×10-3 A/cm2。在pH=7、氨氮初始质量浓度为100 mg/L、无氯离子存在的溶液中,氨氮的去除效果不明显,见图 3。
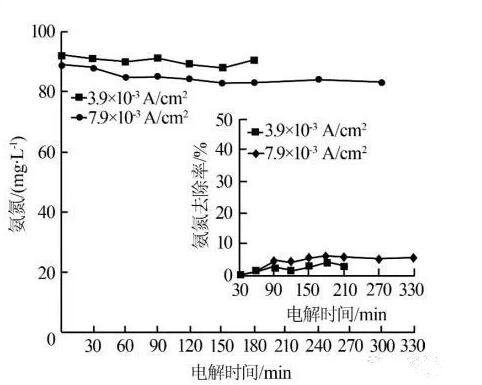
图 3 无氯离子条件下氨氮的去除效果 当电流密度为3.9×10-3 A/cm2,3 h的氨氮去除率百分之四点五,当电流密度增加到7.9×10-3 A/cm2,延长反应时间到5 h,氨氮去除率仅为百分之六。这可能是因为中性条件下,溶液中NH3浓度较低,直接氧化反应不明显。而氨氮浓度的小幅下降,一方面可能是溶液中存在的少量NH3被直接氧化,另一方面电化学氧化过程产生的羟基自由基和原子氧等强氧化剂也可能去除部分氨氮。