废水中氨氮处理技术分析(二)
2022-04-29 来自: 环保水圈 浏览次数:787
2、氨氮的间接氧化机理
(1)电化学反应中活性游离氯的产生过程
图 4为电流密度2.96×10-2 A/cm2、pH=7条件下,0.05 mol/L氯化钠溶液中活性氯随电解时间的变化情况,活性游离氯包括Cl2、HOCl和OCl-。
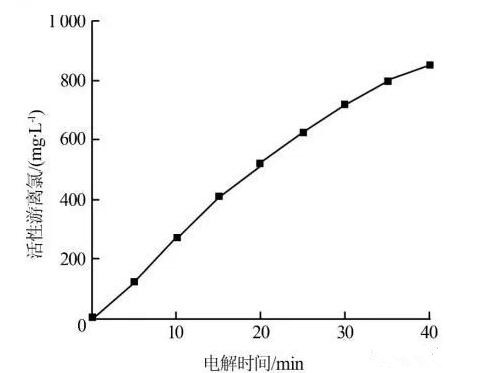
图 4 BDD活性游离氯的变化情况由图4可知,反应15 min内,活性游离氯质量浓度直线上升,15 min后活性氯的增速逐渐变缓。在电解溶液中,氯离子先发生一系列反应产生活性游离氯,使活性游离氯迅速增加。当活性游离氯增加后,与氯酸根离子达到平衡,活性游离氯的反应速率等于氯酸根离子的生成速率,因此活性游离氯质量浓度逐渐趋于定值,而氯酸根离子不断增加。

氯酸根离子可通过两种途径生成,一是次氯酸与次氯酸根发生反应生成氯酸根;另一途径是次氯酸在表面经电化学氧化生成。生成的氯酸根可进一步发生反应。
(2)活性游离氯氧化氨氮的过程
在pH=7、电流密度2.96×10-2 A/cm2、氨氮质量浓度200 mg/L、氯化钠浓度0.05 mol/L条件下考察氨氮的电化学氧化情况,见图 5。

如图 5所示,反应40 min时总余氯(包括活性游离氯和化合氯)为172 mg/L,远远低于无氨氮情况下活性游离氯的质量浓度(851 mg/L,如图 4所示),氨氮则随电解时间延长逐渐降低。说明溶液中大多数活性游离氯在与氨氮的氧化反应中被消耗,而不是生成氯酸盐。据文献报道,活性游离氯中次氯酸和次氯酸根的比例与溶液pH有关,当pH在5~7内,溶液中以次氯酸为主;当pH>8时,以次氯酸根为主。而次氯酸的标准氧化还原电位为1.63 V,远远大于次氯酸根的标准氧化还原电位(0.9 V),因此,中性或偏酸性的溶液更有利于活性游离氯的间接氧化。过量的活性氯和低pH有利于氯胺的分解,生成N2或硝酸盐。
(3)不同氯离子浓度下的反应动力学
假设氨氮的去除反应符合一 级反应,氨氮去除率如式(18)所示。此公式中,氨氮的浓度变化既包括直接氧化作用也包括间接氧化作用。
根据之前的试验结果可知氯离子浓度对氨氮的电化学氧化影响较大。因此,在电流密度为3.94×10-2 A/cm2、pH=11条件下,将不同氯离子浓度下的氨氮变化数据代入式(19),得到图 6。
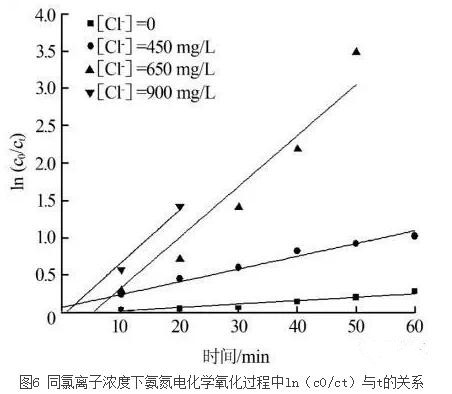
由图 6可知,氨氮的氧化反应符合一 级反应动力学过程,各直线斜率为一 级反应速率常数,不同氯离子浓度对反应速率影响较大,电化学反应速率随氯离子的增加而增加,各相关系数R都>0.9。
三、结论
1、氨氮处于碱性溶液时可在BDD上直接氧化。在pH>8的碱性溶液中,氨氮以NH3形态存在,易发生直接氧化,转化为N2。BDD的析氧电位为2.6 V,游离态NH3的氧化电位为1.8 V,BDD的析氧反应有利于氨氮氧化反应的发生。BDD在氨氮氧化过程中应该有较高的电流效率,如果电压过高则会使溶液发生剧烈的析氧反应,降低电流效率。
2、相对于无氯离子存在的溶液体系,氯离子存在的溶液体系中氨氮的电化学氧化效果更好。
3、在BDD的电化学氧化过程中,活性游离氯更易与氨氮发生反应,而不是转化为氯酸盐。中性或偏酸性的溶液更有利于活性游离氯的间接氧化。过量的活性氯和低pH有利于氯胺的分解,生成N2或硝酸盐。
4、氨氮的氧化反应符合反应动力学过程,电化学反应速率随氯离子的增加而增加。








